界面新闻记者 |
界面新闻编辑 | 谢欣
11月21日,三生制药公告,公司拟拆分子公司蔓迪国际于港交所独立上市。蔓迪国际此次拆分上市的独家保荐人是华泰国际。
界面新闻了解到,三生制药将不会保留蔓迪国际的任何权益,蔓迪国际将不再是三生制药的子公司。受此消息影响,11月21日,三生制药跌9.44%,收盘报29.34港元/股,市值717.7亿港元。
此外,界面新闻还了解到,蔓迪国际于今年10月新任首席财务官杨笛。加入蔓迪国际之前,杨笛曾担任翰宇药业董事、副总裁、董事会秘书及商务拓展(BD)负责人。值得一提的是,在2024年,翰宇药业曾将其司美格鲁肽减肥适应症对外授权。该对外授权的合作对象正是蔓迪国际。
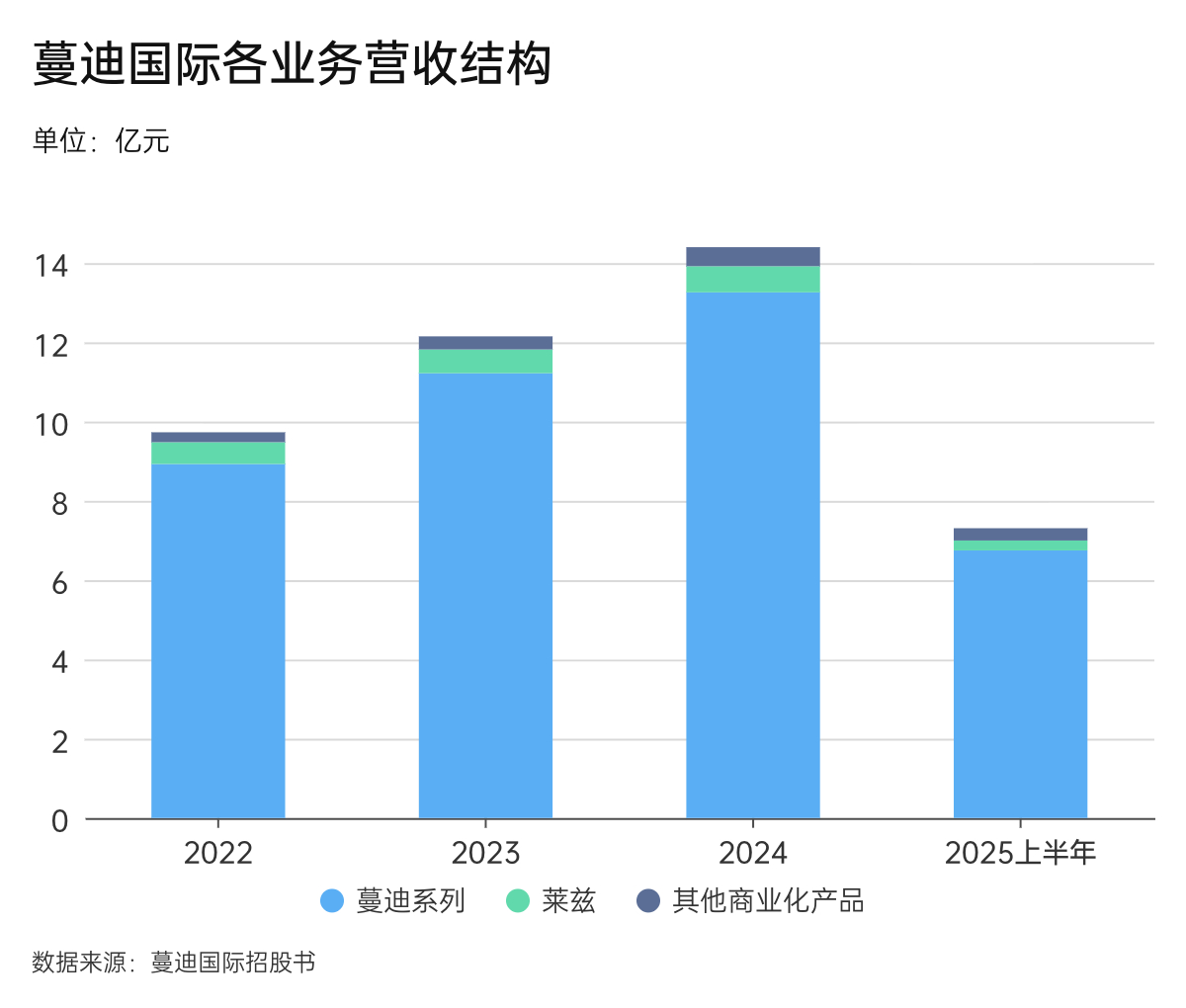
蔓迪国际的主营业务涵盖脱发治疗、皮肤健康管理及体重控制三大领域。2022年到2025年上半年,蔓迪国际总营收分别9.81亿元、12.28亿元、14.55亿元和7.43亿元,净利润2.01亿元、3.4亿元、3.9亿元和1.74亿元,税前息前折旧前摊销前利润(EBITDA) 2.43亿元、4.23亿元、4.57亿元和2.11亿元。


其核心业务是脱发治疗产品蔓迪系列,该系列产品对公司营收的贡献长期保持在九成以上。
据招股书,2022年到2025年上半年,蔓迪系列实现营收8.93亿元、11.22亿元、13.26亿元和6.75亿元,占产品销售总收入的91.7%、92.3%、92.1%、92.4%。
蔓迪国际其他商业化产品及皮肤相关业务对整体业绩的贡献较为有限。据招股书,2022年至2025年上半年,他克莫司软膏(商品名:莱兹)实现营收分别为5528.1万元、5984.7万元、6609.3万元和2507.1万元,占同期产品销售总收入的比例分别为5.7%、4.95%、4.6%和3.4%;其他商业化产品实现营收分别为2597.7万元、3344万元、4766.8万元和 3085.5万元,占同期产品销售总收入的比例分别为2.6%、2.8%、3.3%和4.2%。
蔓迪系列包括蔓迪5%米诺地尔酊剂、蔓迪5%米诺地尔泡沫剂及蔓迪洗发水。米诺地尔是当前最常用的治疗脱发外用药物之一。
据灼识咨询数据,2024年中国约有3.39亿人面临脱发问题,其中超六成年龄在35岁以下。
蔓迪国际堪称“秃头经济”的头号种子选手。早在2001年,蔓迪国际推出中国首款5%浓度的米诺地尔酊剂。2024年,蔓迪国际又推出新剂型蔓迪5%米诺地尔泡沫剂。
2022年至2024年,蔓迪系列米诺地尔累产品销量超5000万瓶。据灼识咨询数据,以零售额计,蔓迪系列自2014年以来,已连续十年蝉联中国脱发治疗药物市场及米诺地尔类药物市场的第一品牌。截至2024年,蔓迪在这两个市场的份额分别为约57%和71%。
除现有蔓迪系列产品外,蔓迪国际正在推进多款米诺地尔泡沫剂新产品的开发,以进一步扩充产品组合。
其中,M2402是一款面向欧盟市场开发的米诺地尔泡沫剂,已于2024年4月启动小规模开发,计划于2026年向欧洲药品管理局(EMA)提交上市许可申请(MAA)。M2405为女性脱发定制产品,已于2024年启动中国Ⅲ期临床,预计2028年上市。
此外,蔓迪国际还开发了2%和5%浓度的米诺地尔搽剂,目前已提交简略新药申请(ANDA)。
在创新产品方面,蔓迪国际正在推进M2506的临床开发。M2506为一款靶向催乳素受体(PRLR)的人源化单克隆抗体,拟作为雄激素性脱发的新型系统性生物治疗方案。2025年11月,公司自沈阳三生引进M2506的开发及商业化独家权益,目前该产品处于Ⅰ期临床研究阶段。
皮肤业务蔓迪国际目前还表现平平。该板块的收入来源为治疗皮肤疾病的软膏莱兹。
莱兹的经营结构具有一定特殊性。尽管该产品的上市许可(旧版批文)归属蔓迪国际,但受限于国家自2016年起推进的仿制药一致性评价政策,该产品在公立医院市场的准入受阻。
根据现行法规,已持有上市许可的企业不得就相同通用名、剂型与规格的药品再次通过一致性评价路径申请新的上市许可。这意味着蔓迪国际虽持有产品批文,但因无法重新申报一致性评价,导致其产品难以进入医院渠道。
为解决这一结构性合规障碍,在蔓迪国际仍隶属于三生制药期间,三生制药通过一致性评价方式申请获得该产品的新版上市许可,并委托蔓迪国际继续作为生产企业。自2025年起,三生制药开始销售该产品。截至2025年6月30日,该产品在三生制药的销售额约170万元。
在此安排下,蔓迪国际作为生产方,主要收入来自许可费用及合同生产(CMO)服务费。目前,蔓迪国际与三生制药均开展该产品的市场销售,形成一定程度的重叠。
蔓迪国际表示,若未来相关法规修订落地(目前仍处于征求意见阶段),公司将重新申请该产品的上市许可,并计划恢复独立销售,届时三生制药将逐步退出该产品市场。
蔓迪国际同时表示,鉴于莱兹在2022年至2025年上半年期间对集团营收贡献持续低于6%,且许可及CMO服务仍可带来稳定收入,加之三生制药当前销售规模有限,现有安排预计不会对公司业务结构或收入划分造成重大影响。
皮肤业务板块或将成为蔓迪国际未来估值增长的潜在支撑点之一,主要得益于其处于Ⅲ期临床阶段的创新产品管线,包括1%柯拉特龙乳膏(Winlevi®)。
柯拉特龙乳膏为一款用于治疗寻常痤疮的外用雄激素受体抑制剂,可通过减少皮脂分泌、缓解炎症实现治疗效果。根据灼识咨询数据,柯拉特龙目前是全球首个且唯一获批用于治疗寻常痤疮的外用雄激素受体抑制剂。
该产品由Cosmo Pharmaceuticals N.V.(瑞士证券交易所代码:COPN,德国证券交易所代码:C43)研发,并于2020年获美国FDA批准,用于治疗12岁及以上患者的寻常痤疮,是自1982年异维A酸以来,全球首款具有新机制的痤疮治疗药物。
2024年,柯拉特龙被纳入美国《寻常痤疮治疗指南》(Guidelines of Care for the Management of Acne Vulgaris)推荐使用,并在Cosmo 2025年半年度报告中被列为美国排名第一的外用痤疮治疗产品。同年8月,该产品还被列入由国家卫健委、工信部及国家药监局联合发布的第五批鼓励研发申报儿童药品清单,成为15款入选药物中唯一的外用皮肤类药物。
2022年7月,蔓迪国际与Cosmo签署许可协议,获得在大中华区开发及商业化1%柯拉特龙乳膏(Winlevi)的独家权利。截至目前,蔓迪国际已完成在中国针对12岁及以上中重度寻常痤疮患者的III期临床试验患者招募,计划于2027年向国家药监局提交药品注册申请。
此外,蔓迪国际还自主研发了白癜风候选药物D2501。但该药物仍处于早期阶段。
蔓迪国际未来估值增长的另一个潜在支撑点来自体重管理领域。相较于脱发及皮肤业务,蔓迪国际在该板块的将面临异常激烈的竞争。
2024年,蔓迪国际从深圳翰宇药业引进了司美格鲁肽注射液。目前,该产品已进入中国Ⅲ期临床试验阶段,预计将在2026年上半年提交药品注册申请。
截至2025年11月14日,中国境内共有16款用于肥胖症或体重管理的司美格鲁肽注射液推进至Ⅲ期或更后期阶段。除诺和诺德的司美格鲁肽(Wegovy)外,尚无其他相关产品在中国获得国家药监局批准。此外,中国还有8款创新型GLP-1R靶向肥胖药物进入Ⅲ期或更晚期开发阶段,另有两款GLP-1/GCG双受体激动剂处于临床开发中,包括派格生物的PB-718(I期)和勃林格殷格翰的Survodutide(Ⅲ期)。
虽然蔓迪国际在同一临床进度层级内推进管线,但“首个国产GLP-1减重药”名号或将被更快推进的企业夺得。例如,11月20日,信达生物宣布其自主研发的玛仕度肽注射液(IBI362)在中重度肥胖人群中的Ⅲ期临床研究(GLORY-2)已达成主要终点及所有关键次要终点,并计划近期向监管机构递交新药上市申请。
除司美格鲁肽外,蔓迪国际亦在推进一款多靶点肥胖治疗候选药物WS2505。该产品为GLP-1R、GIPR及AMYR三重激动剂,采用人工智能辅助的模块化共制剂策略优化其活性、稳定性与给药便利性。目前,先导分子的计算机辅助设计已基本完成,正在进行实验验证与制剂开发工作。